الجدول الدوري للعناصر هو عبارة عن مصفوفة أو جدول ينظم العناصر الكيميائية المكتشفة على حسب عددها الذري (عدد البروتونات في النواة). يتم تصنيف العناصر الكيميائية عموديًا على شكل مجموعات من 1 الى 18 حسب الخصائص الكيميائية لكل عنصر. يحتوي كل عمود على مجموعة من العناصر التي تتشابه في الخصائص.
لمعرفة المزيد عن الجدول الدوري للعناصر سنتناول معًا في هذا المقال أهم خصائص ومجموعات الجدول الدوري اضافة الى أسماء العناصر الكيمائية باللغة العربية.
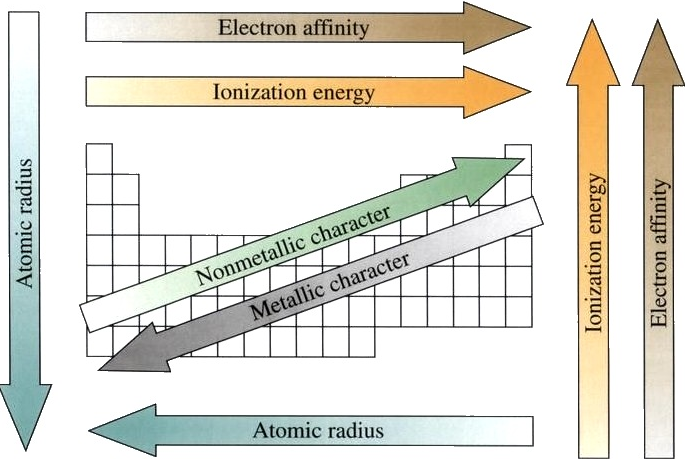
خصائص الجدول الدوري للعناصر :
العناصر في الجدول الدوري مرتبة حسب العدد الذري المتزايد. تُعرض كل هذه العناصر حسب العديد من الاتجاهات ويمكننا استخدام القانون الدوري وتشكيل الجدول للتنبؤ بخصائصها الكيميائية والفيزيائية والذرية.
يتم فهم هذه الاتجاهات من خلال تحليل تكوين العناصر الإلكترونية ؛ تفضل جميع العناصر تشكيل ثماني وستكتسب أو تفقد إلكترونات لتشكيل هذا التكوين المستقر.
1- نصف القطر الذري :
لا يمكننا أبدًا تحديد نصف القطر الذري للذرة لأنه لا يوجد أبدًا احتمال صفري لإيجاد إلكترون ، وبالتالي لا يوجد حد مميز للذرة مطلقًا. كل ما يمكننا قياسه هو المسافة بين نواتين. نصف القطر التساهمي هو نصف المسافة بين نواة ذرتين متطابقتين.
نصف القطر الأيوني هو نصف المسافة بين نوى أيونين في رابطة أيونية. يجب تقسيم المسافة للكاتيون الأصغر والأنيون الأكبر. نصف القطر المعدني هو نصف المسافة بين نواة ذرتين متجاورتين في بنية بلورية. تُترك الغازات النبيلة خارج الاتجاهات في أنصاف الأقطار الذرية بسبب وجود جدل كبير حول القيم التجريبية لأنصاف أقطارها الذرية.
الآن نحن جاهزون لوصف اتجاه نصف القطر الذري في الجدول الدوري. يزيد العدد الذري متحركًا من اليسار إلى اليمين عبر الدورة ، وبالتالي تزداد الشحنة النووية الفعالة. لذلك ، عند التحرك من اليسار إلى اليمين عبر الدورة ، يكون للنواة قوة سحب أكبر للإلكترونات الخارجية ويقل نصف القطر الذري.
2- طاقة التأين :
يتطلب طرد الإلكترون من الذرة طاقة كافية للتغلب على السحب المغناطيسي للشحنة الموجبة للنواة. لذلك ، فإن طاقة التأين هي الطاقة المطلوبة لإزالة الإلكترون تمامًا من ذرة غازية أو أيون. طاقة التأين إيجابية دائمًا.
تزداد طاقات التأين من اليسار إلى اليمين عبر الدورة وتزداد صعودًا عبر كل مجموعة. كلما صعدت مجموعة ، تزداد طاقة التأين ، لأن هناك إلكترونًا يحمي الإلكترونات الخارجية من شد النواة. لذلك ، يتطلب الأمر مزيدًا من الطاقة لإخراج الطاقة من النواة وإزالة الإلكترون.
بينما نتحرك عبر الجدول الدوري من اليسار إلى اليمين ، تزداد طاقة التأين ، بسبب زيادة الشحنة النووية الفعالة. هذا لأنه كلما زادت الشحنة النووية الفعالة ، زادت قوة احتفاظ النواة بالإلكترون وزادت الطاقة اللازمة لإطلاق الإلكترون.
3- تقارب الالكترون :
تقارب الإلكترون هو تغير الطاقة الذي يحدث عندما يضاف إلكترون إلى ذرة غازية. يمكن تعريف تقارب الإلكترون على أنه تغيير المحتوى الحراري الناتج عن إضافة إلكترون إلى ذرة غازية. يمكن أن تكون قيمته موجبة أو سلبية. كلما زادت القيمة السالبة ، كلما كان الأنيون أكثر استقرارًا.
من الصعب التوصل إلى اتجاهات تصف تقارب الإلكترون. بشكل عام ، العناصر الموجودة على الجانب الأيمن من الجدول الدوري سيكون لها تقارب سلبي كبير للإلكترون. ستصبح تقاربات الإلكترون أقل سلبية كلما انتقلت من أعلى إلى أسفل الجدول الدوري.
ومع ذلك ، فإن النيتروجين والأكسجين والفلور لا تتبع هذا الاتجاه. سيكون تكوين إلكترون الغاز النبيل قريبًا من الصفر لأنه لن يكتسب إلكترونات بسهولة.
4- الكهرسلبية :
الكهرسلبية هي قياس قدرة الذرة على جذب الإلكترونات في الجزيء التساهمي. كلما زادت كهرسلبية الذرة ، زادت قدرتها على اكتساب الإلكترونات في الرابطة. ستكون الكهرسلبية مهمة عندما نحدد فيما بعد الجزيئات القطبية وغير القطبية. ترتبط الكهرسلبية بطاقة التأين وتقارب الإلكترون.
تتمتع الإلكترونات ذات طاقات التأين المنخفضة بكهرسلبية منخفضة لأن نواتها لا تمارس قوة جذب قوية على الإلكترونات. العناصر ذات طاقات التأين العالية لها كهرومغناطيسية عالية بسبب الشد القوي الذي تمارسه النواة الموجبة على الإلكترونات السالبة. لذلك تزداد الكهرسلبية من أسفل إلى أعلى ومن اليسار إلى اليمين.
5- الطابع المعدني :
يتم استخدام الطابع المعدني لتحديد الخصائص الكيميائية الموجودة في العناصر المعدنية. بشكل عام ، تميل المعادن إلى فقد الإلكترونات لتكوين الكاتيونات. تميل اللافلزات إلى اكتساب الإلكترونات لتكوين الأنيونات.
كما أنها تتمتع بإمكانية أكسدة عالية وبالتالي فهي تتأكسد بسهولة وهي عوامل اختزال قوية. تشكل المعادن أيضًا أكاسيد قاعدية ؛ كلما كان الأكسيد أساسيًا ، زادت الطابع المعدني للعنصر.
أثناء تحركك عبر الجدول الدوري من اليسار إلى اليمين ، يقل الطابع المعدني ، لأن العناصر تقبل الإلكترونات بسهولة لملء غلاف الطبقة الخاصة بها. لذلك ، تأخذ هذه العناصر الطابع غير المعدني لتشكيل الأنيونات.
كلما تحركت لأعلى الجدول ، يقل الطابع المعدني ، بسبب السحب الأكبر للنواة على الإلكترونات الخارجية. هذا السحب الأكبر يجعل من الصعب على الذرات أن تفقد الإلكترونات وتكوين الكاتيونات.
6- إمكانات الأكسدة والاختزال :
1.6- امكانية الأكسدة :
الأكسدة هي تفاعل ينتج عنه فقدان إلكترون. تتبع إمكانات الأكسدة نفس اتجاهات طاقة التأين. وذلك لأنه كلما قلت طاقة التأين ، كان من الأسهل إزالة الإلكترون.
2.6- امكانية الاختزال :
الاختزال هو رد فعل ينتج عنه اكتساب إلكترون. تتبع إمكانات الاختزال نفس اتجاه تقارب الإلكترون. وذلك لأنه كلما زاد تقارب الإلكترون السالب ، كان من الأسهل إعطاء إلكترون.
قد يهمك : أهم المعلومات الجديدة والغريبة عن الفضاء
ملخص اتجاهات الجدول الدوري للعناصر :
يصنف الجدول الدوري العناصر المتشابهة معًا. كان العالم الروسي دميتري مندلييف أول من أنشأ ترتيبًا مقبولًا على نطاق واسع للعناصر في عام 1869. اعتقد مندلييف أنه عندما يتم ترتيب العناصر بترتيب زيادة الكتلة الذرية ، تتكرر مجموعات معينة من الخصائص بشكل دوري.
على الرغم من أن معظم الجداول الدورية الحديثة مرتبة في ثمانية عشر مجموعة (أعمدة) من العناصر ، فإن الجدول الدوري الأصلي لمندليف كان يحتوي على العناصر المنظمة في ثماني مجموعات واثنتي عشرة دورة (صفوف).
في الجدول الدوري ، توجد العناصر التي لها خصائص متشابهة في نفس المجموعات (عموديًا). من اليسار إلى اليمين ، العدد الذري للعناصر يزداد من دورة إلى أخرى (أفقيًا). المجموعات مرقمة في أعلى كل عمود والنقاط على اليسار بجانب كل صف. عناصر المجموعة الرئيسية هي المجموعات 1،2 و 13 حتى 18.
تحتوي هذه المجموعات على العناصر الأكثر وفرة بشكل طبيعي ، وهي الأكثر أهمية للحياة. تُعرف العناصر المظللة باللون الوردي الفاتح في الجدول بالمعادن الانتقالية. يطلق على صفين من العناصر التي تبدأ عند z = 58 أحيانًا معادن انتقالية داخلية وقد تم استخلاصها ووضعها في أسفل الجدول ، لأنها ستجعل الجدول عريضًا جدًا إذا ظل مستمرًا. تسمى العناصر الـ 14 التالية اللانثانم (z = 57) اللانثانيدات ، والأكتينيوم الـ 14 التالي (z = 89) تسمى الأكتينيدات.
يمكن وضع العناصر في الجدول الدوري في فئتين رئيسيتين ، المعادن واللافلزات. معظم المعادن هي ناقلات جيدة للحرارة والكهرباء ، وهي قابلة للطرق وقابلة للدهن ، وذات درجة انصهار متوسطة إلى عالية.
بشكل عام ، اللافلزات هي مواد غير ناقلة للحرارة والكهرباء ، وهي مواد صلبة غير قابلة للكسر ، والعديد منها غازات في درجة حرارة الغرفة. تمامًا كما هو موضح في الجدول ، غالبًا ما يتم فصل المعادن واللافلزات الموجودة في الجدول الدوري بخط قطري متدرج ، وغالبًا ما يُطلق على العديد من العناصر بالقرب من هذا الخط اسم أشباه الفلزات (Si ، Ge ، As ، Sb ، Te ، At).
أشباه الفلزات هي عناصر تشبه المعادن وفي بعض النواحي تتصرف مثل المعادن ولكن لها أيضًا بعض الخصائص غير المعدنية. تُعرف المجموعة الموجودة في أقصى يمين الجدول ، باللون البرتقالي المظلل ، بالغازات النبيلة. يتم التعامل مع الغازات النبيلة كمجموعة خاصة من اللافلزات.
قد يهمك : أفضل برامج تصميم الفيديو 2021
عائلات (مجموعات) الجدول الدوري الـ 9 :
تُصنف العناصر عادةً على أنها إما معادن أو لافلزات ، لكن الخط الفاصل بين الاثنين غير واضح. عادة ما تكون العناصر المعدنية موصلات جيدة للكهرباء والحرارة. تعتمد المجموعات الفرعية داخل المعادن على الخصائص الكيميائية المتشابهة لهذه المجموعات. يستخدم وصف الجدول الدوري مجموعات العناصر المقبولة عمومًا ، وفقًا لمختبر لوس ألاموس الوطني الأمريكي وفق ما يلي :
- المعادن القلوية: المجموعة 1 (IA) – 1 إلكترون التكافؤ
- معادن الأرض القلوية: المجموعة 2 (IIA) – 2 إلكترونات تكافؤ
- معادن الانتقال: المجموعات 3-12 – تحتوي معادن الكتلة d و f على إلكترونين تكافؤين
- مجموعة البورون أو معادن الأرض: المجموعة 13 (IIIA) – 3 إلكترونات تكافؤ
- مجموعة الكربون أو الرباعي: – المجموعة 14 (IVA) – 4 إلكترونات تكافؤ
- مجموعة النيتروجين أو Pnictogens: – المجموعة 15 (VA) – 5 إلكترونات تكافؤ
- مجموعة الأكسجين أو الكالكوجينات: – المجموعة 16 (VIA) – 6 إلكترونات تكافؤ
- الهالوجينات: – المجموعة 17 (VIIA) – 7 إلكترونات تكافؤ
- الغازات النبيلة: – المجموعة 18 (VIIIA) – 8 إلكترونات تكافؤ
عناصر الجدول الدوري بالعربي :
| الهيدروجين (H) | الغاليوم (Ga) | الساماريوم (Sm) | اليورانيوم (U) |
| الهيليوم (He) | جيرمانيوم (Ge) | يوروبيوم (Eu) | النبتونيوم (Np) |
| الليثيوم (Li) | الزرنيخ (As) | الغادولينيوم (Gd) | البلوتونيوم (Pu) |
| البريليوم (Be) | السيلينيوم (Se) | التربيوم (Tb) | الأمريسيوم (Am) |
| البورون (B) | البروم (Br) | الديسبروسيوم (Dy) | الكوريوم (Cm) |
| الكربون (C) | الكريبتون (Kr) | الهولميوم (Ho) | البركيليوم (Bk) |
| النيتروجين (N) | الروبيديوم (Rb) | الإربيوم (Er) | الكاليفورنيوم (Cf) |
| الأوكسجين (O) | سترونشيوم (Sr) | التوليوم (Tm) | الأينشتاينيوم (Es) |
| الفلورين (F) | الأتريوم (Y) | الإتيربيوم (Yb) | الفرميوم (Fm) |
| النيون (Ne) | الزركونيوم (Zr) | اللوتيشيوم (Lu) | المندليفيوم (Md) |
| الصوديوم (Na) | النيوبيوم (Nb) | الهافنيوم (Hf) | النوبليوم (No) |
| المغنيسيوم (Mg) | موليبدنوم (Mo) | التانتالوم (Ta) | اللورنسيوم (Lr) |
| الألمنيوم (Al) | تكنيشيوم (Tc) | التنجستن (W) | الرذرفورديوم (Rf) |
| السيليكون (Si) | الروثينيوم (Ru) | الرينيوم (Re) | الدوبنيوم (Db) |
| الفوسفور (P) | الروديوم (Rh) | الأوزميوم (Os) | السيبورغيوم (Sg) |
| الكلور (Cl) | بالاديوم (Pd) | الإريديوم (Ir) | البوريوم (Bh) |
| الكبريت (S) | الفضة (Ag) | البلاتين (Pt) | الهاسيوم (Hs) |
| الأرغون (Ar) | كادميوم (Cd) | الذهب (Au) | المايتنريوم (Mt) |
| البوتاسيوم (K) | الإنديوم (In) | الزئبق (Hg) | الدارمشتاتيوم (Ds) |
| الكالسيوم (Ca) | القصدير (Sn) | الثاليوم (Ti) | الرونتيجينيوم (Rg) |
| السكانديوم (Sc) | الإثمد (Sb) | الرصاص (Pb) | الكوبرنيسيوم (Cn) |
| التيتانيوم (Ti) | التيلوريوم (Te) | البزموت (Bi) | النيهونيوم “أنون تريوم” (NH) |
| الفاناديوم (V) | اليود (I) | البولونيوم (Po) | الفليروفيوم (Fl) |
| الكروم (Cr) | الزينون (Xe) | الأستاتين (At) | الموسكوفيوم (Mc) |
| المنغنيز (Mn) | السيزيوم (Cs) | الراديون (Rn) | الليفرموريوم (LV) |
| الحديد (Fe) | اللانثانوم (Ba) | الفرانسيوم (Fr) | التينيسين (TS) |
| الكوبالت (Co) | السيريوم (La) | الراديوم (Ra) | الأوغانيسون (Og) |
| النيكل (Ni) | البراسوديميوم (Pr) | الأكتينيوم (Ac) | |
| النحاس (Cu) | نيوديميوم (Nd) | الثوريوم (Th) | |
| الزنك (Zn) | بروميثيوم (Pm) | بروتكتينيوم (Pa) |
المراجع :
- موقع livescience
- موقع thoughtco
- موقع chem.libretexts.org
- موقع pubchem.ncbi.nlm.nih.gov

